
点击右上角![]() 微信好友
微信好友
 朋友圈
朋友圈

请使用浏览器分享功能进行分享

11月6日,国家药监局药品审评中心(CDE)信息显示,上海鼎新基因科技有限公司(下称“鼎新基因”)自主研发生产的RRG001眼内注射液的临床试验申请(IND)获临床试验静默许可,拟申请用于年龄相关性湿性黄斑病变(nAMD)。
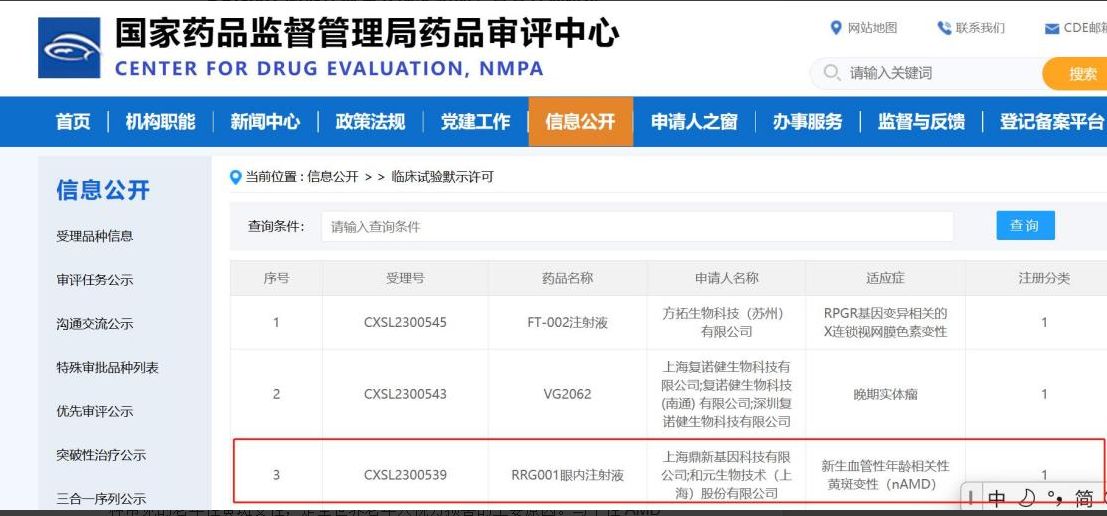
该项目已于2023年2月在江苏省人民医院开展了研究者发起的临床试验(IIT研究)。初步的临床研究数据显示:受试者临床获益显著,且无任何严重不良事件发生。
RRG001使用了天然的AAV衣壳,在临床拟用剂量上低于国外同类产品,预期具有更佳的安全性。同时,本次IND默示许可开展的研究是一项单臂、开放标签、多中心的I/IIa期临床试验,旨在评价RRG001对湿性年龄相关性黄斑变性(nAMD)受试者的安全性、耐受性和有效性。
此次获临床试验静默许可的适应症针对的是年龄相关性湿性黄斑变性,是一种常见的老年性黄斑变性,是全世界老年人视力损害的主要原因。与干性AMD不同,湿性AMD患者的视力损害更为严重,且晚期AMD的视力难以逆转。因此,尽早的药物干预成为防止视力丧失的最优选择。
据了解,鼎新基因是一家专注于眼科、耳科、代谢科等领域基因治疗产品开发的公司。已在眼底病、先天性耳聋等领域建立了成熟的AAV基因治疗研发和技术体系。
鼎新基因创始人周睿表示,RRG001注射液已具备大规模生产的能力,且成本优势明显。有望使以往天价的基因治疗药物变得更为普惠,让更多的患者受益。接下来,鼎新基因将加速推进RRG001的注册临床研究,期待能尽早为湿性AMD患者带来光明。
值得一提的是,RRG001是鼎新基因拥有自主知识产权的重组腺相关病毒(rAAV)基因治疗药物。它采用创新的视网膜下腔给药方式,能针对性地将表皮生长因子受体(VEGFR)融合蛋白基因导入nAMD患者眼底。(张梦凡)
